Objetivo
La materia, sus propiedades, constitución y medida.
la estructura microscópica de la materia.
La teoría cinética de la materia.
Los principales estados de agregación de la materia.
Los cambios de estado de agregación de la materia.
La medida de las principales propiedades materiales.
Sistema Internacional de medida y unidades.
Ejemplos de los principales tipos de magnitudes y unidades.
¿Qué es la materia?
Con palabras sencillas, podemos decir que materia es todo lo que existe, ocupa un espacio y se puede pesar. Materia son los cuerpos que vemos, tocamos, medimos, etc. De una forma más rigurosa, materia se define como:
Materia es todo lo que existe, tiene masa y volumen.
La masa y el volumen son dos propiedades fundamentales de la materia que estudiamos en este tema.
Si pudiéramos ver los cuerpos materiales con un microscopio muy potente, veríamos que todos los cuerpos están formados por unas partículas llamados átomos.
Hay átomos de diferentes tipo. Los átomos se pueden diferenciar entre sí por su masa ( unos pesan más que otros), por su tamaño ( unos mayores que otros) y por la forma que tienen de unirse a otros átomos.
Todos los cuerpos materiales están formadas por unas partículas llamadas átomos.


En este tema consideramos a los átomos como eternos e indestructibles.
Unión de átomos
Los átomos pueden unirse entre sí, formando compuestos. Estos átomos que se unen pueden ser iguales o distintos. Cuando los átomos se unen dicen que forman enlaces.
La fuerza con la que se unen los átomos depende del tipo o naturaleza de los átomos que se unen.
Hay átomos que se atraen entre sí con mucha fuerza y se unen muy fuertemente y otro que prácticamente no se atraen nada y no se unen.
Los átomos dependiendo de su naturaleza pueden unirse entre sí formando enlaces.
Temperatura
Intuitivamente asociamos la temperatura de un cuerpo a si éste está caliente o frío. La pregunta es:¿qué diferencia hay entre un cuerpo con más temperatura que otro con menos?
Si mirásemos las partículas o átomos que componen un cuerpo, veríamos que éstas se mueven, y se mueven más rápido cuando mayor es la temperatura del cuerpo y viceversa. Si las partículas ganan energía aumenta la temperatura y si la pierde baja.
La temperatura está directamente relacionada con la rapidez (velocidad) o energía que tienen los átomos o partículas que componen los cuerpos.
El aparato más utilizado para medir la temperatura es el termómetro.
Teoría cinética de la materia
Los cuerpos están formados por átomos, que pueden unirse entre sí, tienen energía y están en movimiento. Que los átomos estén unidos o separados entre sí depende de dos factores:
1) De la fuerza con la que átomos se atraen, que depende del tipo de átomos que se unen.
2) De la temperatura o energía que poseen los átomos. Si los átomos se mueven más rápido (más temperatura) será más fácil que se separen que si se mueven más lentos (menos temperatura).
Que los átomos estén unidos entre sí depende del tipo de átomos y de la temperatura.
Por ellos, las sustancias están en estado sólido, líquido o gas.
Estados de la materia
Gaseoso
Las partículas de los gases se atraen muy poco entre sí y están separados.
La estructura microscópica de los gases explica que presente propiedades:
Su forma y su volumen es la del recipiente que lo contienen. Se pueden comprimir (reducir o aumentar su tamaño). Pueden fluir (viajar de un sitio a otro deslizándose por el medio).Los gases ejercen presión ( fuerza sobre las paredes del recipiente que los contienen).
Las temperaturas altas favorecen que las sustancias estén en estado gaseoso.
Sólido
Las partículas de los sólidos se atraen con mucha fuerza entre sí y están fuertemente unidas.
Las partículas de los sólidos sólo pueden vibrar,
y vibrarán más rápido cuanto mayor sea la
temperatura. La atracción entre partículas es fuerte.
La estructura microscópica de los sólidos explica que presenten las siguientes propiedades:
Su forma y volumen son fijos y no varían. Son incomprensibles (no se reducen al ser presionados). No fluyen. Los sólidos ejercen presión sólo sobre los cuerpos que están apoyados en él.
Las temperaturas bajas favorecen que las sustancias estén en estado sólido.
Líquido
Las partículas de los líquidos se atraen con con fuerza intermedia entre sí y las partículas están unidas pero se mueven o deslizan unas con respecto de otras.
Las partículas de los líquidos se mueven pero
manteniéndose, unidas al conjunto. Se mueven
más rápido cuanto mayor sea la temperatura.
La atracción entre partículas es intermedia.
La estructura microscópica de los líquidos explica que presenten las siguientes propiedades:
Su forma es la del recipiente que lo contiene y su volumen es fijo, no varía. Son incomprensibles (no se reducen al ser presionados). Pueden fluir. Los líquidos ejercen presión sobre las paredes de los recipientes que los contienen.
Las temperaturas intermedias favorece que las sustancias estén en estado líquido.
2. Propiedades de la materia
Masa
Todos los cuerpos tienen masa. Una definición de la masa es: "calidad de la materia que tiene un cuerpo".
Otra manera más intuitiva de definir la masa es: la masa de un cuerpo se relaciona directamente con la cantidad de átomos o partículas que contienen . Cuanto más átomos más masa y viceversa.
La masa de un cuerpo mide la cantidad de átomos o partículas que contienen.
Notas: también depende del tipo de átomos ya que unos átomos tienen más masa que otros.
Volumen
Volumen es el espacio que ocupan un cuerpo.
Todos los cuerpos que existen tienen volumen, ya que ocupan un lugar en el espacio.
El volumen de un cuerpo es el que ocupan los átomos que lo componen más el espacio entre ellos (espacio interatomico).
El espacio ocupado por un cuerpo no puede ser ocupado por otro cuerpo a la vez (principio de impenetrabilidad de los cuerpos).
Densidad
Hemos visto que todos los cuerpos tienen masa y volumen, es decir que están formados por átomos que ocupan un espacio.
A la división entre la masa y el volumen de un cuerpo se le llama densidad d=m/v
Los átomos de un cuerpo pueden estar más o menos juntos, es decir, en un mismo espacio puede haber más o menos átomos.
Un cuerpo denso es aquel que tiene muchos átomos en un espacio determinado, es decir, los átomos están muy juntos. Mientras que si hay mucho espacio entre ellos será poco denso.
masa: 30,2 kg volumen: 27,0m3
masa = 30,2kg= 1,12 kg/m3
volumen= 27,0m3=
Otras propiedades de la materia
Los cuerpos materiales tienen otras muchas propiedades. A continuación comentaremos algunas de ellas a modo de ejemplo:
-Dureza. Indica si es fácil o difícil de rayar.
-Índice de refracción. Indica si la luz y las ondas viajan más o menos rápido en el interior de un cuerpo.
-Conductividad eléctrica y térmica. Indica si el calor y la electricidad pasa o no con facilidad a través del cuerpo.
Dimensiones de los cuerpos
En el espacio que conocemos hay tres dimensiones llamadas: ancho, largo y alto.
Todo los cuerpos son tridimensionales (3 dimensiones), por ejemplo: un balón, un silla, un coche, etc.
Sin embargo, hay cuerpos que tienen una dimensión mucho más pequeña que las otras dos. Son cuerpo bidimensionales. Por ejemplo, un folio o un mantel son muy finos y en la práctica se tienen en cuenta dos dimensiones: ancho y largo.
Hay cuerpos, como por ejemplo un hilo o una cuerda, en los que predomina una sola dimensión, son cuerpos unidimensionales.
Cambio de estados
Hemos visto que el estado de un sustancia de lo factores: naturaleza de la sustancia (de ella depende de la fuerza de la union entre sus átomos) y temperatura (de ella depende la energía o rapidez con la que se mueven los átomos).
Las partículas de los gases se mueven libremente,
y se mueven más rápido cuanto mayor sea la
temperatura. La atracción entre partículas es débil.
Un cuerpo en estado sólido al que se le aumenta su temperatura hace que su partículas se muevan más rápido asta que se separen y pasa a estado líquido o gaseoso. Lo contrario pasa si se baja la temperatura, las partículas tendrán menos energía y tenderán a estar en estado líquido o sólido.
Las temperaturas intermedias favorecen que las sustancias estén en estado líquido
Magnitud, medida y unidades
Magnitud . Es cualquier propiedad (del universo) que puede medir o calcular de alguna forma. Ejemplos tiempo, masa, fuerza, longitud, velocidad, aceleración, etc.
Medida . Es el resultado de comparar dos magnitudes de la misma naturaleza. Ejemplo: cuando se mide el tiempo se compara lo que tarda en ocurrir algo con lo que tarda las agujas del reloj en dar las vueltas, estoy comparando un tiempo (fenómeno) con otro (reloj).
unidad de medida .Cantidad de una determinada magnitud que se toma como referencia. Actualmente las establece el sistema Internacional de unidades (S.I.).
Ejemplo. la unidad de tiempo es el segundo, por tanto comparo lo que tarda cualquier fenómeno con el segundo.
Sistemas Internacionales (SI)
El sistema Internacional (SI) es un sistema de unidades establecido por una conferencia internacional.
El SI también se llama "sistema métrico" y fue creado en 1960. La gran mayoría de los países utilizan este sistema de unidades.
Magnitudes.El SI ha establecido siete magnitudes como fundamentales o básicas. Todas las demás son derivadas y utiliza a las fundamentales para definirse.
Unidad de medida. El SI asigna una magnitud a cada unidad. También establece las equivalencias entre las unidades del SI y otras unidades de la misma magnitud.
Conversión de unidades
La unidades pueden tener múltiplos o submúltiplos que son prefijos que se colocan delante de la unidad y que la multiplica o divide respectivamente por la unidad seguida de cero.
Ejemplo: un Kilómetro son mil metros (kilo multiplica por mil al metro).
Una misma magnitud puede medirse con distintas unidades, una de ellas es elegida por SI y las otras no, pero tienen una equivalencia entre ellas. Ejemplo: metro y millas. Ambos miden longitud, pero el metro es la unidad del SI.
Para convertir unas unidades en otras, o para cambiar entre los múltiplos y submúltiplos de una misma unidad, se puede usar: multiplicación o división por la unidad seguida de cero, las reglas de tres, fórmulas y los factores de conversión.
CAMBIOS DE UNIDADES
Conversión pesetas a euros
166,386pesetas--------1 euro
0 pesetas ----------------------------x euros
masa
Masa. Cantidad de materia que tiene un cuerpo.
Tipo de magnitud: fundamental.
Unidad SI: kilogramos (kg).
Instrumentos de medida: balanza, báscula, granatario, peso...
Otras unidades:libra onza, UTM arroba quintal, grano, tonelada...
Ejemplo: 2 kg. La magnitud medida es la masa en la unidad kilogramos. La cantidad medida es 2 (hay 2 veces un kilogramo). Se ha medido con una balanza.
Longitud
Longitud. Distancia entre dos puntos.
Tipo de magnitud: fundamental.
Unidad SI: metro (m).
Instrumentos de medidas: cinta métrica, regla de medir, técnicas láser...
Otras unidades: yarda, milla marina, milla terrestre, pie, cuarta, codo...
Ejemplo: 5m. La magnitud medida es la longitud en la longitud en la unidad metros. La cantidad medida es 5 (hay 5 veces un metro). Se ha medido con una cinta métrica.
Tiempo
Tiempo. Duración de un fenómeno.
Tipo de magnitud: fundamental.
Unidad SI: segundo (s).
Instrumentos de medida: cronómetro, reloj digital, reloj de arena, clepsidra...
Otra unidades: minuto, hora, dia, mes, año, cron, eón...
Ejemplo: 8 m. La magnitud medida es el tiempo en la unidad segundos. La cantidad medida es 8 (hay 8 veces un segundo). Se ha medido con un cronómetro.
Temperatura
Temperatura. Medida de la cantidad de energía de las partículas de un cuerpo.
Tipo de magnitud: fundamental.
Unidad SI: Kelvin (K).
Instrumentos de medida: termómetro, termopar, resistencia eléctrica...
Otras unidades: grado Celsius, Fahrenheit, Reaumur...
Ejemplo: 3 k. La magnitud medida es la temperatura en la unidad kelvin. La cantidad medida es 3 (hay 3 veces un Kelvin). Se ha medido con termómetro.
Superficie
Superficie. Espacio bidimensional que ocupa un cuerpo.
Tipo de magnitud: derivada.
Unidad SI: metro cuadrado (m2).
Medida: superficie = longitud1 x longitud2
Otras unidades: área, acre, milla cuadrada, rood...
Ejemplo: 2 m2. La magnitud medida es la superficie en la unidad metro cuadrado. La cantidad medida es 2 (hay 2 veces un metro cuadrado). Se ha medido con una fórmula (largo por ancho).
Volumen
Volumen. Espacio tridimensional que ocupa un cuerpo.
Tipo de magnitud: derivada.
Unidad SI: metro cúbico (m3).
Medida: volumen = longitud1 x longitud2 x longitud3. Probeta, pipeta, bureta, matraz aforado...
Otras unidades: litro, barril, pinta, galón, gota, taza...
Ejemplos: 3 m3. La magnitud medida es el volumen en la unidad metro cúbico. La cantidad medida es 3 (hay 3 veces un metro cúbico). Se ha medido con una fórmula (largo por ancho por alto).
Densidad
Densidad. Relación entre la masa que tiene un cuerpo y el espacio que éste ocupa.
Tipo de magnitud: derivada.
unidad SI: kilogramos/metro cúbico (kg/m3)
Medida: densidad = masa/volumen. Densímetro, picnómetro, balanza hidrostática...
Otras unidades: gramos por mililitro, onza por pulgada cúbica, slug por pie cúbico, libra por galón...
Ejemplo: 6kg/m3. La magnitud medida es la densidad en la unidad kilogramo por metro cúbico. La cantidad medida es 6 (hay 6 veces un kilogramo en metro cúbico). Se ha medido con un densímetro.
UNIDAD 5:LOS ÁTOMOS Y LAS MOLÉCULAS
·Lee atentamente:
1. La misma sustancia en los tres estados.
Todo los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc.
Todas las sustancias están formadas por partículas muy pequeñas llamadas moléculas, que no podemos ver a simple vista.
Una sustancia cambia de estado (sólido, líquido o gaseoso) según se encuentren situadas las partículas que la forman.
Las sustancias pueden estar en estado sólido, líquido o gaseoso.
· En las sustancias sólidas las moléculas se encuentran situadas muy cerca unas de otras y no pueden moverse.
· En las sustancias líquidas las moléculas se encuentran situadas más separadas que en las sólidas y pueden moverse ligeramente. por eso, se colocan adoptando la forma del recipiente que las contiene.
· En las sustancias gaseosas las moléculas están muy separadas y se mueven libremente, ocupando todo el espacio posible, y pudiéndose comprimir ("apretarse").
Las propiedades de una sustancia (su color, etc.) dependen del tipo de molécula que la forma y de su disposición en el espacio.
2. Las moléculas
Las diferentes sustancias está formadas por distintos tipos de moléculas, con diferente forma y disposición en el espacio.
Una sustancia pura está toda ella formada por un solo tipo de moléculas,
y todas son iguales.
Por ejemplo, el agua pura está formada únicamente por un tipo de moléculas.
3. La masa , el volumen y las moléculas en un cambio de estado.
Cuando se produce en cambio de estado, la masa no varía, es decir, la cantidad de materia es siempre la mima, ya que el número de moléculas que forman la sustancia es siempre el mismo, solamente varía la distancia entre ellas.
Pero en un cambio de estado el volumen varía; esto es debido a que las moléculas se juntan o se separan más entre ellas, ocupando más o menos espacio.
4. LAS MOLÉCULAS ESTÁN FORMADAS POR ÁTOMOS
Las moléculas están formadas por
partículas más pequeñas llamadas
átomos.
En la actulidad se conocen
105 tipos de átomos distintos:
átomos de hidrógeno, oxigeno,etc.
Las moléculas se diferencian unas de otras por el tipo de átomos que las
forman y el número de ellos presentes en cada una.
Los átomos que forman una molécula
puedes ser:
·Iguales, cuando forman sustancias puras.
·Distintos: formando así los compuestos.
Para dibujar y representar los átomos se utilizan modelos moleculares; éstos son esferas de colores y cada una de ellas representa un tipo de átomo.
5. Estructura de los átomos
Los átomos constan de dos partes, el núcleo y la corteza.
El núcleo contiene partículas cargadas positivamente, (llamadas protones), y partículas sin carga,
llamadas neutrones.
Rodeando al núcleo está la corteza, en la que se encuentran los electrones, partículas cargadas negativamente que giran en torno al núcleo.
6. El sistema periódico
(o tabla periódica de los elementos químicos).
Para ordenar y clasificar los átomos se realizó la tabla periódica, en la que se encuentran representados de forma ordenada todos los tipos de átomos que existen, y que son unos 105.
Cada tipo de átomo constituye un elemento químico diferente.
Cada elemento químico tiene un nombre, pero para representarlo de forma más sencilla se utiliza un símbolo.
En cada casilla de la tabla periódica se encuentran escritos datos del elemento como la densidad, la masa o su número atómico.
Los elementos químicos que forman la tabla periódica se dividen en varios grupos: los metales, los semimetales, los no metales y los gases nobles.
· Fijándote en tabla periódica, completa:
7 . Representar moléculas por medio de fórmula
Para representar las moléculas que forman la materia se utilizan las fórmulas.
Una fórmula indica de forma resumida:
· El o los tipo de átomos que forman la molécula.
· El número de átomos de cada tipo que la forman.
Para escribir una fórmula se escribe el símbolo de cada uno de los átomos que forman la molécula y al lado derecho de cada símbolo y situado un poco más bajo de átomos de este tipo que forman parte de la molécula.
Por ejemplo:
- El agua : H2O
Está formada por átomos de hidrógeno uno de oxígeno.
- El dióxido de carbono: CO2
Está formada por un átomo de carbono y dos de oxígenos.
· La molécula de gas oxígenos se representa así:
O2
· La molécula de metano se representa así:
CH4
· Las moléculas de gas butano que se utilizan en las cocinas de las casas está formadas por: 4 átomos de carbono y 10 átomos de hidrógeno. Represéntala.
8 . Las moléculas pueden cambiar
Cuando se produce un cambio de estado o una disolución, las moléculas no cambian, simplemente se alejan, se acercan o se mezclan.
Este tipo de cambio en el cual las moléculas no resultan alteradas recibe el nombre de cambio físico.
Sin embargo, también se pueden producir transformaciones en las moléculas en las cuales los átomos se reagrupan formando moléculas nuevas, diferentes a las que teníamos al principio.
9. Cómo se representa una reacción química
En una reacción química las sustancias iniciales reciben el nombre de reactivos, y las sustancias finales, productos.
Para escribir de forma resumida una reacción química, se escriben las fórmulas de los productos que reaccionan y a continuación las fórmulas de los productos que se obtienen.
Por ejemplo, la combustión del carbón:
C + O2 ----- CO2
El carbón y el gas oxígeno reaccionan y dan lugar al dióxido de carbono.
En una reacción química el número de átomos se mantienen.
En una reacción química se cumple la ley de la conservación de la materia: la masa de las sustancias que reacciona es igual a la masa de la sustancias que se obtiene.
Movimiento rectilíneo 2015-05-11
 los movimientos rectilíneos, que siguen una línea recta, son los movimientos más sencillos. Movimientos más complicados pueden ser estudiados como la composición de movimientos rectilíneos elementales. Tal es el caso, por ejemplo, de los movimientos de proyectiles.
los movimientos rectilíneos, que siguen una línea recta, son los movimientos más sencillos. Movimientos más complicados pueden ser estudiados como la composición de movimientos rectilíneos elementales. Tal es el caso, por ejemplo, de los movimientos de proyectiles.
El movimiento rectilíneo puede expresarse o presentase como
Movimiento rectilíneo uniformemente acelerado.
Este último puede, a su vez, presentarse como de caída libre o de subida vertical.
Movimiento rectilíneo uniforme
El movimiento rectilíneo uniforme (MRU) fue definido, por primera vez, por Galileo en los siguientes términos: "Por movimientos igual o uniforme entiendo aquél en el que los espacios recorridos por un móvil en tiempos iguales, tómense como se tomen, resultan iguales entre sí", o, dicho de otro modo, es un movimiento de velocidad v constante.
El MRUse caracteriza por:
a) Movimiento que se realiza en una sola dirección en el eje horizontal.
d
b) Velocidad constante; implica magnitud, sentido y dirección inalterables.
c) la magnitud dela velocidad recibe el nombre de rapidez. Este movimiento no presenta aceleración (aceleración =0).
Concepto de rapidez y de velocidad
Muy fáciles de confundir, son usados a menudo como equivalentes para referirse a uno u otro.
Pero la rapidez (r) representa un valor numérico, una magnitud:por ejemplo, 30 km/h.
En cantidad de la velocidad representa un vector que incluye un valor numérico (30km/h.) y que además posee un sentido y una dirección.
Cuando hablemos de rapidez habrá dos elementos muy importantes que considera:la distancia (d) y el tiempo (t), íntimamente relacionados.
Así :
Sí dos movimientos demoran el mismo tiempo en recorrer distancias distintas, tiene mayor rapidez aquel que recorre la mayor de ellas.
Si dos móviles recorren la misma distancia en tiempos distintos, tienen mayor rapidez aquel que lo hace en menor tiempo.
Significado físico de la rapidez
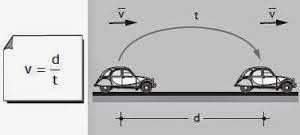
La rapidez se calcula o se expresa en relación a la distancia recorrida en cierta unidad de tiempo y su fórmula general es la siguiente:
Usa v para representar la rapidez, la cual es igual al cociente entre la distancia (d) recogida y el tiempo (t) empleado para hacerlo.
Como corolario, la distancia estará dada por la fórmula:
d = v · t
Según esta, la distancia recorrida por un móvil de multiplicar su rapidez por el tiempo empleado.
A su vez, si se quiere calcular el tiempo empleado en recorrer cierta distancia usamos
t = d/v
El tiempo está dado por el cociente entre la distancia y la rapidez con que se hace.
Problemas o ejercicios sobre el movimiento rectilíneo uniforme:
Ejercicio 1
Un automóvil se desplaza con una rapidez de 30 m por segundo, con movimiento rectilíneo uniforme.
Calcule la distancia que recorrerá en 12 segundos.
Analicemos los datos que nos dan:
v = 30 m /seg
t =12 seg
d = x
Apliquemos la fórmula conocida:
t = d/v > d =v · t
y remplacemos con los datos conocidos:
d = v · t = 30 m/seg = 360 m
¿Qué hicimos? Para calcular la distancia (d),valor desconocido, multiplicamos la rapidez (v) por el tiempo (t), simplificamos la unidad segundos y nos queda el resultado final en metros recorridos en 12 segundos: 360 metro
Ejercicio 2
 El automóvil de la figura se desplaza con movimiento rectilíneo uniforme ¿cuánto demorará en recorrer 258 kilómetro si se mueve con una rapidez de 85 kilómetros por hora?
El automóvil de la figura se desplaza con movimiento rectilíneo uniforme ¿cuánto demorará en recorrer 258 kilómetro si se mueve con una rapidez de 85 kilómetros por hora?
Analicemos los datos que nos dan:
v = 86 km/h
d = 258 km
t = x
Apliquemos la fórmula conocida para calcular el tiempo:
t = d/v
y reemplacemos con los datos que tenemos:
t = 258 km/86 h = 3
¿Qué hicimos? Para calcular el tiempo (t), valor desconocido, dividimos la distancia (d) por la rapidez (v), simplificamos la unidad kilómetros y nos queda el resultado final en final en horas: 3 horas para recorrer 258 km con una rapidez de 86 km a la hora.
Ejercicio 3
¿Con qué rapidez se desplaza un móvil que recorre 774 metro en 59 segundos?
Analicemos los datos conocidos:
t = 59 seg
d =774 m
v = x
Aplicamos la fórmula conocida para calcular la rapidez:
v = d/t = 774m/59seg = 13,11 m/seg
¿Qué hicimos? Para calcular la rapidez (v), dividido la distancia (d) por el tiempo (t), y nos queda el resultado final: la rapidez del móvil para recorrer 779 metros en 59 segundos: 13,11 metros por segundo.
Ejercicio 4
Los dos automóviles de la figura desde un mismo punto, con movimiento rectilíneo uniforme. El amarillo (móvil A) se desplaza hacia el norte a 90 km por hora, y el rojo (móvil B), hacia el sur a 80 km por hora. Calcular la distancia que los separa al cabo de 2 horas.
Para el móvil A
vA = 90km/h
tA = 2h
dA = x
Para el móvil B:
vB = 80 km/h
tB =2h
dB = x
Calculamos la distancia que recorre el móvil A:
vA = dA/tA > dA = vA · tA = 80 km/h ·2 h = 160 km
Calculamos la distancia que recorre el móvil B:
vB = dB/tB > dB=vB · tB = 90 km/h · h = 180km
Sumamos ambos distancias y nos da 340 km como la distancia que separa a ambos automóviles luego de 2 horas de marcha.
Ejercicio 5
El corredor de la figura trota de un extremo a otro de la pista en linea recta 300 m en 2,5 min., luego se devuelve y trota 100m hacia el punto de partida en otro minuto.
Preguntas: ¿Cuál es la rapidez promedio del atleta al recorrer ambas distancias? ¿Cuál es rapidez media del atleta al recorrer los 400 metros?
Veamos los datos que tenemos:
Para el primer tramo:
v1 = x1
t1 = 2,5 min
d1 = 300 m
Calculamos su rapidez:
v1 = d1/t1 = 300m/2,5min 120 m/min
Para el segundo tramo:
Calculamos su rapidez:
v2 = d2/t2 =100m/1min = 100 m/min
Rapidez promedio:
120 m/min +100 m/min = 220m/min /2 = 110 m/min
La rapidez promedio del atleta fue de 110 metros por minuto.
Veamos ahora cuál fue la velocidad media (vm) para recorrer los 400metros:
vm = d total/t total = 400m/3,5min = 114,29 m/min
La rapidez media del atleta fue de 114,29 metros por minuto.
La masa y el volumen son dos propiedades fundamentales de la materia que estudiamos en este tema.
Si pudiéramos ver los cuerpos materiales con un microscopio muy potente, veríamos que todos los cuerpos están formados por unas partículas llamados átomos.
Hay átomos de diferentes tipo. Los átomos se pueden diferenciar entre sí por su masa ( unos pesan más que otros), por su tamaño ( unos mayores que otros) y por la forma que tienen de unirse a otros átomos.
Todos los cuerpos materiales están formadas por unas partículas llamadas átomos.


En este tema consideramos a los átomos como eternos e indestructibles.
Unión de átomos
Los átomos pueden unirse entre sí, formando compuestos. Estos átomos que se unen pueden ser iguales o distintos. Cuando los átomos se unen dicen que forman enlaces.
La fuerza con la que se unen los átomos depende del tipo o naturaleza de los átomos que se unen.
Hay átomos que se atraen entre sí con mucha fuerza y se unen muy fuertemente y otro que prácticamente no se atraen nada y no se unen.
Los átomos dependiendo de su naturaleza pueden unirse entre sí formando enlaces.
Temperatura
Intuitivamente asociamos la temperatura de un cuerpo a si éste está caliente o frío. La pregunta es:¿qué diferencia hay entre un cuerpo con más temperatura que otro con menos?
Si mirásemos las partículas o átomos que componen un cuerpo, veríamos que éstas se mueven, y se mueven más rápido cuando mayor es la temperatura del cuerpo y viceversa. Si las partículas ganan energía aumenta la temperatura y si la pierde baja.
La temperatura está directamente relacionada con la rapidez (velocidad) o energía que tienen los átomos o partículas que componen los cuerpos.
El aparato más utilizado para medir la temperatura es el termómetro.
Teoría cinética de la materia
Los cuerpos están formados por átomos, que pueden unirse entre sí, tienen energía y están en movimiento. Que los átomos estén unidos o separados entre sí depende de dos factores:
1) De la fuerza con la que átomos se atraen, que depende del tipo de átomos que se unen.
2) De la temperatura o energía que poseen los átomos. Si los átomos se mueven más rápido (más temperatura) será más fácil que se separen que si se mueven más lentos (menos temperatura).
Que los átomos estén unidos entre sí depende del tipo de átomos y de la temperatura.
Por ellos, las sustancias están en estado sólido, líquido o gas.
Estados de la materia
Gaseoso
Las partículas de los gases se atraen muy poco entre sí y están separados.
La estructura microscópica de los gases explica que presente propiedades:
Su forma y su volumen es la del recipiente que lo contienen. Se pueden comprimir (reducir o aumentar su tamaño). Pueden fluir (viajar de un sitio a otro deslizándose por el medio).Los gases ejercen presión ( fuerza sobre las paredes del recipiente que los contienen).
Las temperaturas altas favorecen que las sustancias estén en estado gaseoso.
Sólido
Las partículas de los sólidos se atraen con mucha fuerza entre sí y están fuertemente unidas.
Las partículas de los sólidos sólo pueden vibrar,
y vibrarán más rápido cuanto mayor sea la
temperatura. La atracción entre partículas es fuerte.
La estructura microscópica de los sólidos explica que presenten las siguientes propiedades:
Su forma y volumen son fijos y no varían. Son incomprensibles (no se reducen al ser presionados). No fluyen. Los sólidos ejercen presión sólo sobre los cuerpos que están apoyados en él.
Las temperaturas bajas favorecen que las sustancias estén en estado sólido.
Líquido
Las partículas de los líquidos se atraen con con fuerza intermedia entre sí y las partículas están unidas pero se mueven o deslizan unas con respecto de otras.
Las partículas de los líquidos se mueven pero
manteniéndose, unidas al conjunto. Se mueven
más rápido cuanto mayor sea la temperatura.
La atracción entre partículas es intermedia.
La estructura microscópica de los líquidos explica que presenten las siguientes propiedades:
Su forma es la del recipiente que lo contiene y su volumen es fijo, no varía. Son incomprensibles (no se reducen al ser presionados). Pueden fluir. Los líquidos ejercen presión sobre las paredes de los recipientes que los contienen.
Las temperaturas intermedias favorece que las sustancias estén en estado líquido.
2. Propiedades de la materia
Masa
Todos los cuerpos tienen masa. Una definición de la masa es: "calidad de la materia que tiene un cuerpo".
Otra manera más intuitiva de definir la masa es: la masa de un cuerpo se relaciona directamente con la cantidad de átomos o partículas que contienen . Cuanto más átomos más masa y viceversa.
La masa de un cuerpo mide la cantidad de átomos o partículas que contienen.
Notas: también depende del tipo de átomos ya que unos átomos tienen más masa que otros.
Volumen
Volumen es el espacio que ocupan un cuerpo.
Todos los cuerpos que existen tienen volumen, ya que ocupan un lugar en el espacio.
El volumen de un cuerpo es el que ocupan los átomos que lo componen más el espacio entre ellos (espacio interatomico).
El espacio ocupado por un cuerpo no puede ser ocupado por otro cuerpo a la vez (principio de impenetrabilidad de los cuerpos).
Densidad
Hemos visto que todos los cuerpos tienen masa y volumen, es decir que están formados por átomos que ocupan un espacio.
A la división entre la masa y el volumen de un cuerpo se le llama densidad d=m/v
Los átomos de un cuerpo pueden estar más o menos juntos, es decir, en un mismo espacio puede haber más o menos átomos.
Un cuerpo denso es aquel que tiene muchos átomos en un espacio determinado, es decir, los átomos están muy juntos. Mientras que si hay mucho espacio entre ellos será poco denso.
masa: 30,2 kg volumen: 27,0m3
masa = 30,2kg= 1,12 kg/m3
volumen= 27,0m3=
Otras propiedades de la materia
Los cuerpos materiales tienen otras muchas propiedades. A continuación comentaremos algunas de ellas a modo de ejemplo:
-Dureza. Indica si es fácil o difícil de rayar.
-Índice de refracción. Indica si la luz y las ondas viajan más o menos rápido en el interior de un cuerpo.
-Conductividad eléctrica y térmica. Indica si el calor y la electricidad pasa o no con facilidad a través del cuerpo.
Dimensiones de los cuerpos
En el espacio que conocemos hay tres dimensiones llamadas: ancho, largo y alto.
Todo los cuerpos son tridimensionales (3 dimensiones), por ejemplo: un balón, un silla, un coche, etc.
Sin embargo, hay cuerpos que tienen una dimensión mucho más pequeña que las otras dos. Son cuerpo bidimensionales. Por ejemplo, un folio o un mantel son muy finos y en la práctica se tienen en cuenta dos dimensiones: ancho y largo.
Hay cuerpos, como por ejemplo un hilo o una cuerda, en los que predomina una sola dimensión, son cuerpos unidimensionales.
Cambio de estados
Hemos visto que el estado de un sustancia de lo factores: naturaleza de la sustancia (de ella depende de la fuerza de la union entre sus átomos) y temperatura (de ella depende la energía o rapidez con la que se mueven los átomos).
Las partículas de los gases se mueven libremente,
y se mueven más rápido cuanto mayor sea la
temperatura. La atracción entre partículas es débil.
Un cuerpo en estado sólido al que se le aumenta su temperatura hace que su partículas se muevan más rápido asta que se separen y pasa a estado líquido o gaseoso. Lo contrario pasa si se baja la temperatura, las partículas tendrán menos energía y tenderán a estar en estado líquido o sólido.
Las temperaturas intermedias favorecen que las sustancias estén en estado líquido
Magnitud, medida y unidades
Magnitud . Es cualquier propiedad (del universo) que puede medir o calcular de alguna forma. Ejemplos tiempo, masa, fuerza, longitud, velocidad, aceleración, etc.
Medida . Es el resultado de comparar dos magnitudes de la misma naturaleza. Ejemplo: cuando se mide el tiempo se compara lo que tarda en ocurrir algo con lo que tarda las agujas del reloj en dar las vueltas, estoy comparando un tiempo (fenómeno) con otro (reloj).
unidad de medida .Cantidad de una determinada magnitud que se toma como referencia. Actualmente las establece el sistema Internacional de unidades (S.I.).
Ejemplo. la unidad de tiempo es el segundo, por tanto comparo lo que tarda cualquier fenómeno con el segundo.
Sistemas Internacionales (SI)
El sistema Internacional (SI) es un sistema de unidades establecido por una conferencia internacional.
El SI también se llama "sistema métrico" y fue creado en 1960. La gran mayoría de los países utilizan este sistema de unidades.
Magnitudes.El SI ha establecido siete magnitudes como fundamentales o básicas. Todas las demás son derivadas y utiliza a las fundamentales para definirse.
Unidad de medida. El SI asigna una magnitud a cada unidad. También establece las equivalencias entre las unidades del SI y otras unidades de la misma magnitud.
Conversión de unidades
La unidades pueden tener múltiplos o submúltiplos que son prefijos que se colocan delante de la unidad y que la multiplica o divide respectivamente por la unidad seguida de cero.
Ejemplo: un Kilómetro son mil metros (kilo multiplica por mil al metro).
Una misma magnitud puede medirse con distintas unidades, una de ellas es elegida por SI y las otras no, pero tienen una equivalencia entre ellas. Ejemplo: metro y millas. Ambos miden longitud, pero el metro es la unidad del SI.
Para convertir unas unidades en otras, o para cambiar entre los múltiplos y submúltiplos de una misma unidad, se puede usar: multiplicación o división por la unidad seguida de cero, las reglas de tres, fórmulas y los factores de conversión.
CAMBIOS DE UNIDADES
Conversión pesetas a euros
166,386pesetas--------1 euro
0 pesetas ----------------------------x euros
masa
Masa. Cantidad de materia que tiene un cuerpo.
Tipo de magnitud: fundamental.
Unidad SI: kilogramos (kg).
Instrumentos de medida: balanza, báscula, granatario, peso...
Otras unidades:libra onza, UTM arroba quintal, grano, tonelada...
Ejemplo: 2 kg. La magnitud medida es la masa en la unidad kilogramos. La cantidad medida es 2 (hay 2 veces un kilogramo). Se ha medido con una balanza.
Longitud
Longitud. Distancia entre dos puntos.
Tipo de magnitud: fundamental.
Unidad SI: metro (m).
Instrumentos de medidas: cinta métrica, regla de medir, técnicas láser...
Otras unidades: yarda, milla marina, milla terrestre, pie, cuarta, codo...
Ejemplo: 5m. La magnitud medida es la longitud en la longitud en la unidad metros. La cantidad medida es 5 (hay 5 veces un metro). Se ha medido con una cinta métrica.
Tiempo
Tiempo. Duración de un fenómeno.
Tipo de magnitud: fundamental.
Unidad SI: segundo (s).
Instrumentos de medida: cronómetro, reloj digital, reloj de arena, clepsidra...
Otra unidades: minuto, hora, dia, mes, año, cron, eón...
Ejemplo: 8 m. La magnitud medida es el tiempo en la unidad segundos. La cantidad medida es 8 (hay 8 veces un segundo). Se ha medido con un cronómetro.
Temperatura
Temperatura. Medida de la cantidad de energía de las partículas de un cuerpo.
Tipo de magnitud: fundamental.
Unidad SI: Kelvin (K).
Instrumentos de medida: termómetro, termopar, resistencia eléctrica...
Otras unidades: grado Celsius, Fahrenheit, Reaumur...
Ejemplo: 3 k. La magnitud medida es la temperatura en la unidad kelvin. La cantidad medida es 3 (hay 3 veces un Kelvin). Se ha medido con termómetro.
Superficie
Superficie. Espacio bidimensional que ocupa un cuerpo.
Tipo de magnitud: derivada.
Unidad SI: metro cuadrado (m2).
Medida: superficie = longitud1 x longitud2
Otras unidades: área, acre, milla cuadrada, rood...
Ejemplo: 2 m2. La magnitud medida es la superficie en la unidad metro cuadrado. La cantidad medida es 2 (hay 2 veces un metro cuadrado). Se ha medido con una fórmula (largo por ancho).
Volumen
Volumen. Espacio tridimensional que ocupa un cuerpo.
Tipo de magnitud: derivada.
Unidad SI: metro cúbico (m3).
Medida: volumen = longitud1 x longitud2 x longitud3. Probeta, pipeta, bureta, matraz aforado...
Otras unidades: litro, barril, pinta, galón, gota, taza...
Ejemplos: 3 m3. La magnitud medida es el volumen en la unidad metro cúbico. La cantidad medida es 3 (hay 3 veces un metro cúbico). Se ha medido con una fórmula (largo por ancho por alto).
Densidad
Densidad. Relación entre la masa que tiene un cuerpo y el espacio que éste ocupa.
Tipo de magnitud: derivada.
unidad SI: kilogramos/metro cúbico (kg/m3)
Medida: densidad = masa/volumen. Densímetro, picnómetro, balanza hidrostática...
Otras unidades: gramos por mililitro, onza por pulgada cúbica, slug por pie cúbico, libra por galón...
Ejemplo: 6kg/m3. La magnitud medida es la densidad en la unidad kilogramo por metro cúbico. La cantidad medida es 6 (hay 6 veces un kilogramo en metro cúbico). Se ha medido con un densímetro.
UNIDAD 5:LOS ÁTOMOS Y LAS MOLÉCULAS
·Lee atentamente:
1. La misma sustancia en los tres estados.
Todo los cuerpos están formados por sustancias: las personas, los coches, los muebles, el aire, etc.
Todas las sustancias están formadas por partículas muy pequeñas llamadas moléculas, que no podemos ver a simple vista.
Una sustancia cambia de estado (sólido, líquido o gaseoso) según se encuentren situadas las partículas que la forman.
Las sustancias pueden estar en estado sólido, líquido o gaseoso.
· En las sustancias sólidas las moléculas se encuentran situadas muy cerca unas de otras y no pueden moverse.
· En las sustancias líquidas las moléculas se encuentran situadas más separadas que en las sólidas y pueden moverse ligeramente. por eso, se colocan adoptando la forma del recipiente que las contiene.
· En las sustancias gaseosas las moléculas están muy separadas y se mueven libremente, ocupando todo el espacio posible, y pudiéndose comprimir ("apretarse").
Las propiedades de una sustancia (su color, etc.) dependen del tipo de molécula que la forma y de su disposición en el espacio.
2. Las moléculas
Las diferentes sustancias está formadas por distintos tipos de moléculas, con diferente forma y disposición en el espacio.
Una sustancia pura está toda ella formada por un solo tipo de moléculas,
y todas son iguales.
Por ejemplo, el agua pura está formada únicamente por un tipo de moléculas.
Una mezcla está formada por vario tipos distinto de moléculas.Un ejemplo de mezcla es el agua con azúcar.
3. La masa , el volumen y las moléculas en un cambio de estado.
Cuando se produce en cambio de estado, la masa no varía, es decir, la cantidad de materia es siempre la mima, ya que el número de moléculas que forman la sustancia es siempre el mismo, solamente varía la distancia entre ellas.
Pero en un cambio de estado el volumen varía; esto es debido a que las moléculas se juntan o se separan más entre ellas, ocupando más o menos espacio.
4. LAS MOLÉCULAS ESTÁN FORMADAS POR ÁTOMOS
Las moléculas están formadas por
partículas más pequeñas llamadas
átomos.
En la actulidad se conocen
105 tipos de átomos distintos:
átomos de hidrógeno, oxigeno,etc.
Las moléculas se diferencian unas de otras por el tipo de átomos que las
forman y el número de ellos presentes en cada una.
Los átomos que forman una molécula
puedes ser:
·Iguales, cuando forman sustancias puras.
·Distintos: formando así los compuestos.
Para dibujar y representar los átomos se utilizan modelos moleculares; éstos son esferas de colores y cada una de ellas representa un tipo de átomo.
5. Estructura de los átomos
Los átomos constan de dos partes, el núcleo y la corteza.
El núcleo contiene partículas cargadas positivamente, (llamadas protones), y partículas sin carga,
llamadas neutrones.
Rodeando al núcleo está la corteza, en la que se encuentran los electrones, partículas cargadas negativamente que giran en torno al núcleo.
CONSTITUCIÓN DEL ÁTOMO
|
||
Núcleo
|
Protones
|
Carga
positiva (+)
|
Neutrones
|
Sin
carga
|
|
Corteza
|
Electrones
|
Carga
negativa (-)
|
6. El sistema periódico
(o tabla periódica de los elementos químicos).
Para ordenar y clasificar los átomos se realizó la tabla periódica, en la que se encuentran representados de forma ordenada todos los tipos de átomos que existen, y que son unos 105.
Cada tipo de átomo constituye un elemento químico diferente.
Cada elemento químico tiene un nombre, pero para representarlo de forma más sencilla se utiliza un símbolo.
En cada casilla de la tabla periódica se encuentran escritos datos del elemento como la densidad, la masa o su número atómico.
Los elementos químicos que forman la tabla periódica se dividen en varios grupos: los metales, los semimetales, los no metales y los gases nobles.
· Fijándote en tabla periódica, completa:
7 . Representar moléculas por medio de fórmula
Para representar las moléculas que forman la materia se utilizan las fórmulas.
Una fórmula indica de forma resumida:
· El o los tipo de átomos que forman la molécula.
· El número de átomos de cada tipo que la forman.
Para escribir una fórmula se escribe el símbolo de cada uno de los átomos que forman la molécula y al lado derecho de cada símbolo y situado un poco más bajo de átomos de este tipo que forman parte de la molécula.
Por ejemplo:
- El agua : H2O
Está formada por átomos de hidrógeno uno de oxígeno.
- El dióxido de carbono: CO2
Está formada por un átomo de carbono y dos de oxígenos.
· La molécula de gas oxígenos se representa así:
O2
· La molécula de metano se representa así:
CH4
· Las moléculas de gas butano que se utilizan en las cocinas de las casas está formadas por: 4 átomos de carbono y 10 átomos de hidrógeno. Represéntala.
8 . Las moléculas pueden cambiar
Cuando se produce un cambio de estado o una disolución, las moléculas no cambian, simplemente se alejan, se acercan o se mezclan.
Este tipo de cambio en el cual las moléculas no resultan alteradas recibe el nombre de cambio físico.
Sin embargo, también se pueden producir transformaciones en las moléculas en las cuales los átomos se reagrupan formando moléculas nuevas, diferentes a las que teníamos al principio.
9. Cómo se representa una reacción química
En una reacción química las sustancias iniciales reciben el nombre de reactivos, y las sustancias finales, productos.
Para escribir de forma resumida una reacción química, se escriben las fórmulas de los productos que reaccionan y a continuación las fórmulas de los productos que se obtienen.
Por ejemplo, la combustión del carbón:
C + O2 ----- CO2
El carbón y el gas oxígeno reaccionan y dan lugar al dióxido de carbono.
En una reacción química el número de átomos se mantienen.
En una reacción química se cumple la ley de la conservación de la materia: la masa de las sustancias que reacciona es igual a la masa de la sustancias que se obtiene.
Movimiento rectilíneo 2015-05-11
 los movimientos rectilíneos, que siguen una línea recta, son los movimientos más sencillos. Movimientos más complicados pueden ser estudiados como la composición de movimientos rectilíneos elementales. Tal es el caso, por ejemplo, de los movimientos de proyectiles.
los movimientos rectilíneos, que siguen una línea recta, son los movimientos más sencillos. Movimientos más complicados pueden ser estudiados como la composición de movimientos rectilíneos elementales. Tal es el caso, por ejemplo, de los movimientos de proyectiles.El movimiento rectilíneo puede expresarse o presentase como
Movimiento rectilíneo uniformemente acelerado.
Este último puede, a su vez, presentarse como de caída libre o de subida vertical.
Movimiento rectilíneo uniforme
El movimiento rectilíneo uniforme (MRU) fue definido, por primera vez, por Galileo en los siguientes términos: "Por movimientos igual o uniforme entiendo aquél en el que los espacios recorridos por un móvil en tiempos iguales, tómense como se tomen, resultan iguales entre sí", o, dicho de otro modo, es un movimiento de velocidad v constante.
El MRUse caracteriza por:
a) Movimiento que se realiza en una sola dirección en el eje horizontal.
d
b) Velocidad constante; implica magnitud, sentido y dirección inalterables.
c) la magnitud dela velocidad recibe el nombre de rapidez. Este movimiento no presenta aceleración (aceleración =0).
Concepto de rapidez y de velocidad
Muy fáciles de confundir, son usados a menudo como equivalentes para referirse a uno u otro.
Pero la rapidez (r) representa un valor numérico, una magnitud:por ejemplo, 30 km/h.
En cantidad de la velocidad representa un vector que incluye un valor numérico (30km/h.) y que además posee un sentido y una dirección.
Cuando hablemos de rapidez habrá dos elementos muy importantes que considera:la distancia (d) y el tiempo (t), íntimamente relacionados.
Así :
Sí dos movimientos demoran el mismo tiempo en recorrer distancias distintas, tiene mayor rapidez aquel que recorre la mayor de ellas.
Si dos móviles recorren la misma distancia en tiempos distintos, tienen mayor rapidez aquel que lo hace en menor tiempo.
Significado físico de la rapidez
La rapidez se calcula o se expresa en relación a la distancia recorrida en cierta unidad de tiempo y su fórmula general es la siguiente:
Usa v para representar la rapidez, la cual es igual al cociente entre la distancia (d) recogida y el tiempo (t) empleado para hacerlo.
Como corolario, la distancia estará dada por la fórmula:
d = v · t
Según esta, la distancia recorrida por un móvil de multiplicar su rapidez por el tiempo empleado.
A su vez, si se quiere calcular el tiempo empleado en recorrer cierta distancia usamos
t = d/v
El tiempo está dado por el cociente entre la distancia y la rapidez con que se hace.
Problemas o ejercicios sobre el movimiento rectilíneo uniforme:
Ejercicio 1
Un automóvil se desplaza con una rapidez de 30 m por segundo, con movimiento rectilíneo uniforme.
Calcule la distancia que recorrerá en 12 segundos.
Analicemos los datos que nos dan:
v = 30 m /seg
t =12 seg
d = x
Apliquemos la fórmula conocida:
t = d/v > d =v · t
y remplacemos con los datos conocidos:
d = v · t = 30 m/seg = 360 m
¿Qué hicimos? Para calcular la distancia (d),valor desconocido, multiplicamos la rapidez (v) por el tiempo (t), simplificamos la unidad segundos y nos queda el resultado final en metros recorridos en 12 segundos: 360 metro
Ejercicio 2
 El automóvil de la figura se desplaza con movimiento rectilíneo uniforme ¿cuánto demorará en recorrer 258 kilómetro si se mueve con una rapidez de 85 kilómetros por hora?
El automóvil de la figura se desplaza con movimiento rectilíneo uniforme ¿cuánto demorará en recorrer 258 kilómetro si se mueve con una rapidez de 85 kilómetros por hora?Analicemos los datos que nos dan:
v = 86 km/h
d = 258 km
t = x
Apliquemos la fórmula conocida para calcular el tiempo:
t = d/v
y reemplacemos con los datos que tenemos:
t = 258 km/86 h = 3
¿Qué hicimos? Para calcular el tiempo (t), valor desconocido, dividimos la distancia (d) por la rapidez (v), simplificamos la unidad kilómetros y nos queda el resultado final en final en horas: 3 horas para recorrer 258 km con una rapidez de 86 km a la hora.
Ejercicio 3
¿Con qué rapidez se desplaza un móvil que recorre 774 metro en 59 segundos?
Analicemos los datos conocidos:
t = 59 seg
d =774 m
v = x
Aplicamos la fórmula conocida para calcular la rapidez:
v = d/t = 774m/59seg = 13,11 m/seg
¿Qué hicimos? Para calcular la rapidez (v), dividido la distancia (d) por el tiempo (t), y nos queda el resultado final: la rapidez del móvil para recorrer 779 metros en 59 segundos: 13,11 metros por segundo.
Ejercicio 4
Los dos automóviles de la figura desde un mismo punto, con movimiento rectilíneo uniforme. El amarillo (móvil A) se desplaza hacia el norte a 90 km por hora, y el rojo (móvil B), hacia el sur a 80 km por hora. Calcular la distancia que los separa al cabo de 2 horas.
Veamos los datos que tenemos:
Para el móvil A
vA = 90km/h
tA = 2h
dA = x
Para el móvil B:
vB = 80 km/h
tB =2h
dB = x
Calculamos la distancia que recorre el móvil A:
vA = dA/tA > dA = vA · tA = 80 km/h ·2 h = 160 km
Calculamos la distancia que recorre el móvil B:
vB = dB/tB > dB=vB · tB = 90 km/h · h = 180km
Sumamos ambos distancias y nos da 340 km como la distancia que separa a ambos automóviles luego de 2 horas de marcha.
Ejercicio 5
El corredor de la figura trota de un extremo a otro de la pista en linea recta 300 m en 2,5 min., luego se devuelve y trota 100m hacia el punto de partida en otro minuto.
Preguntas: ¿Cuál es la rapidez promedio del atleta al recorrer ambas distancias? ¿Cuál es rapidez media del atleta al recorrer los 400 metros?
Veamos los datos que tenemos:
Para el primer tramo:
v1 = x1
t1 = 2,5 min
d1 = 300 m
Calculamos su rapidez:
v1 = d1/t1 = 300m/2,5min 120 m/min
Para el segundo tramo:
Calculamos su rapidez:
v2 = d2/t2 =100m/1min = 100 m/min
Rapidez promedio:
120 m/min +100 m/min = 220m/min /2 = 110 m/min
La rapidez promedio del atleta fue de 110 metros por minuto.
Veamos ahora cuál fue la velocidad media (vm) para recorrer los 400metros:
vm = d total/t total = 400m/3,5min = 114,29 m/min
La rapidez media del atleta fue de 114,29 metros por minuto.